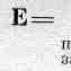Lekcia 1.
Téma: Množstvo látky. Krtko
Chémia je veda o látkach. Ako meriate látky? V akých jednotkách? V molekulách, ktoré tvoria látky, je to však veľmi ťažké. V gramoch, kilogramoch alebo miligramoch, ale takto sa meria hmotnosť. Ale čo ak skombinujeme hmotnosť, ktorá je nameraná na váhe, a počet molekúl látky, je to možné?
a) H-vodík
An = 1a.u.m.
1a.u.m = 1,66 x 10-24 g
Vezmime si 1 g vodíka a vypočítame počet atómov vodíka v tejto hmote (ponúknite študentom, aby to urobili pomocou kalkulačky).
N n \u003d 1 g / (1,66 * 10 -24) g \u003d 6,02 * 10 23
b) O-kyslík
A o \u003d 16 a.u.m \u003d 16 * 1,67 * 10 – 24 g
Nie \u003d 16 g / (16 * 1,66 * 10 -24) g \u003d 6,02 * 10 23
c) C-uhlík
A c \u003d 12a.u.m \u003d 12 * 1,67 * 10 -24 g
N c \u003d 12 g / (12 * 1,66 * 10 -24) g \u003d 6,02 * 10 23
Urobme záver: ak vezmeme takú hmotnosť látky, ktorá sa svojou veľkosťou rovná atómovej hmotnosti, ale berieme ju v gramoch, potom bude vždy (pre akúkoľvek látku) 6,02 * 10 23 atómov tejto látky.
H20 - voda
18 g / (18 * 1,66 * 10 -24) g \u003d 6,02 * 10 23 molekúl vody atď.
Na \u003d 6,02 * 10 23 - Avogadrove číslo alebo konštanta.
Mol - množstvo látky, ktoré obsahuje 6,02 * 10 23 molekúl, atómov alebo iónov, t.j. štruktúrne jednotky.
Existuje mól molekúl, mól atómov, mól iónov.
n je počet mólov (počet mólov sa často označuje ako nu),
N je počet atómov alebo molekúl,
N a = Avogadrova konštanta.
Kmol \u003d 10 3 mol, mmol \u003d 10-3 mol.
Ukážte portrét Amedea Avogadra na multimediálnej inštalácii a krátko o ňom porozprávajte, prípadne požiadajte študenta, aby pripravil krátku správu o živote vedca.
2. lekcia
Téma "Molárna hmotnosť hmoty"
Aká je hmotnosť 1 mólu látky? (Študenti môžu často urobiť záver sami.)
Hmotnosť jedného mólu látky sa rovná jej molekulovej hmotnosti, ale vyjadruje sa v gramoch. Hmotnosť jedného mólu látky sa nazýva molárna hmotnosť a označuje sa - M.
Vzorce:
M - molárna hmotnosť,
n je počet mólov,
m je hmotnosť látky.
Hmotnosť mólu sa meria v g/mol, hmotnosť kmol sa meria v kg/kmol a hmotnosť mmol sa meria v mg/mol.
Vyplňte tabuľku (tabuľky sú distribuované).
Látka |
Počet molekúl |
Molárna hmota |
Počet krtkov |
Hmotnosť hmoty |
5 mol |
||||
H2SO4 |
||||
12 ,0 4*10 26 |
Lekcia 3
Téma: Molárny objem plynov
Poďme vyriešiť problém. Určte objem vody, ktorej hmotnosť je za normálnych podmienok 180 g.
Vzhľadom na to:
Tie. objem kvapalných a pevných telies sa vypočíta pomocou hustoty.
Pri výpočte objemu plynov však nie je potrebné poznať hustotu. prečo?
Taliansky vedec Avogadro určil, že rovnaké objemy rôznych plynov za rovnakých podmienok (tlak, teplota) obsahujú rovnaký počet molekúl – toto tvrdenie sa nazýva Avogadrov zákon.
Tie. ak za rovnakých podmienok V (H 2) \u003d V (O 2), potom n (H 2) \u003d n (O 2) a naopak, ak za rovnakých podmienok n (H 2) \u003d n (O 2 ) potom budú objemy týchto plynov rovnaké. A mol látky vždy obsahuje rovnaký počet molekúl 6,02 * 10 23 .
Usudzujeme - za rovnakých podmienok by moly plynov mali zaberať rovnaký objem.
Za normálnych podmienok (t = 0, P = 101,3 kPa alebo 760 mm Hg) móly akýchkoľvek plynov zaberajú rovnaký objem. Tento objem sa nazýva molárny.
V m \u003d 22,4 l / mol
1 kmol zaberá objem -22,4 m 3 / kmol, 1 mmol zaberá objem -22,4 ml / mmol.
Príklad 1(Rozhodnuté na rade):
Príklad 2(Môžete požiadať študentov, aby vyriešili):
| Vzhľadom na to: | Riešenie: |
m(H2) \u003d 20 g |
Požiadajte študentov, aby doplnili tabuľku.
Látka |
Počet molekúl |
Hmotnosť hmoty |
Počet krtkov |
Molárna hmota |
Objem |
Teoretický materiál nájdete na stránke "Molárny objem plynu".
Základné vzorce a pojmy:
Z Avogadrovho zákona napríklad vyplýva, že za rovnakých podmienok obsahuje 1 liter vodíka a 1 liter kyslíka rovnaký počet molekúl, hoci ich veľkosti sa značne líšia.
Prvý dôsledok Avogadrovho zákona:
Objem, ktorý zaberá 1 mol akéhokoľvek plynu za normálnych podmienok (n.s.) je 22,4 litra a je tzv. molárny objem plynu(Vm).
V m \u003d V / ν (m 3 / mol)
Čo sa nazýva normálne podmienky (n.o.):
- normálna teplota = 0 °C alebo 273 K;
- normálny tlak = 1 atm alebo 760 mmHg alebo 101,3 kPa
Z prvého dôsledku Avogadrovho zákona vyplýva, že napríklad 1 mól vodíka (2 g) a 1 mól kyslíka (32 g) zaberá rovnaký objem, rovnajúci sa 22,4 litrom pri n.o.
Ak poznáte V m, môžete nájsť objem akéhokoľvek množstva (ν) a akúkoľvek hmotnosť (m) plynu:
V=Vm ν V=Vm (m/M)
Typická úloha 1: Aký je objem na n.o.s. zaberá 10 mólov plynu?
V = V m v = 22,4 10 = 224 (l/mol)
Typická úloha 2: Aký je objem na n.o.s. spotrebuje 16 g kyslíka?
V(02)=Vm.(m/M)Mr(02)=32; M(02) \u003d 32 g / mol V (02) \u003d 22,4 (16/32) \u003d 11,2 l
Druhý dôsledok Avogadrovho zákona:
Keď poznáme hustotu plynu (ρ=m/V) pri n.o., môžeme vypočítať molárnu hmotnosť tohto plynu: M = 22,4 p
Hustota (D) jedného plynu sa inak nazýva pomer hmotnosti určitého objemu prvého plynu k hmotnosti podobného objemu druhého plynu za rovnakých podmienok.
Ukážka úlohy 3: Určte relatívnu hustotu oxidu uhličitého z vodíka a vzduchu.
D vodík (CO 2) \u003d Mr (CO 2) / M r (H 2) \u003d 44/2 \u003d 22 D vzduch \u003d 44/29 \u003d 1,5
- jeden objem vodíka a jeden objem chlóru poskytujú dva objemy chlorovodíka: H2 + Cl2 \u003d 2HCl
- dva objemy vodíka a jeden objem kyslíka dávajú dva objemy vodnej pary: 2H 2 + O 2 \u003d 2H 2 O
Úloha 1. Koľko mólov a molekúl obsahuje 44 g oxidu uhličitého.
Riešenie:
M(CO 2) \u003d 12 + 16 2 \u003d 44 g / mol ν \u003d m / M \u003d 44/44 \u003d 1 mol N (CO 2) \u003d ν N A \u003d 1 6,02 1 6,02 1 6,02 1 10 23
Úloha 2 . Vypočítajte hmotnosť jednej molekuly ozónu a atómu argónu.
Riešenie:
M(O 3) \u003d 16 3 \u003d 48 g m (O 3) \u003d M (O 3) / N A \u003d 48 / (6,02 10 23) \u003d 7,97 10 -23 g M (Ar) \u00 g (Ar) \u003d M (Ar) / N A \u003d 40 / (6,02 10 23) \u003d 6,65 10 -23 g
Úloha 3 . Aký je objem u n.o. zaberá 2 móly metánu.
Riešenie:
ν \u003d V / 22,4 V (CH 4) \u003d ν 22,4 \u003d 2 22,4 \u003d 44,8 l
Úloha 4 . Určte hustotu a relatívnu hustotu oxidu uhoľnatého (IV) pre vodík, metán a vzduch.
Riešenie:
Mr (C02) = 12 + 16,2 = 44; M(C02)=44 g/mol Mr(CH4)=12+14=16; M(CH4)=16 g/mol Mr(H2)=12=2; M(H2)=2 g/mol Mr(vzduch)=29; M (vzduch) \u003d 29 g / mol ρ \u003d m / V ρ (CO 2) \u003d 44 / 22,4 \u003d 1,96 g / mol D (CH 4) \u003d M (CO 2) / M (CH 4) = 44/16 = 2,75 D(H2)=M(C02)/M(H2)=44/2=22 D(vzduch)=M(C02)/M(vzduch)=44/24= 1,52
Úloha 5. Určte hmotnosť plynnej zmesi, ktorá obsahuje 2,8 metrov kubických metánu a 1,12 metrov kubických oxidu uhoľnatého.
Riešenie:
Mr (C02) = 12 + 16,2 = 44; M(C02)=44 g/mol Mr(CH4)=12+14=16; M(CH 4) \u003d 16 g / mol 22,4 metrov kubických CH 4 \u003d 16 kg 2,8 metrov kubických CH 4 \u003d x m (CH 4) \u003d x \u003d 2,8 16 / 22,4 \u0023d 2 kg kubických metrov CO2 \u003d 28 kg 1,12 metrov kubických CO 2 \u003d x m (CO 2) \u003d x \u003d 1,12 28 / 22,4 \u003d 1,4 kg m (CH 4) + m (CO 2) \u01,4 kg + 4 = 2
Úloha 6. Určte objemy kyslíka a vzduchu potrebné na spálenie 112 metrov kubických dvojmocného oxidu uhoľnatého s obsahom nehorľavých nečistôt v ňom v objemových zlomkoch 0,50.
Riešenie:
- určiť objem čistého CO v zmesi: V (CO) \u003d 112 0,5 \u003d 66 metrov kubických
- určiť objem kyslíka potrebného na spálenie 66 metrov kubických CO: 2CO + O 2 \u003d 2CO 2 2 mol + 1 mol 66 m 3 + X m 3 V (CO) \u003d 2 22,4 \u003d 44,8 m 3 V (O 2) \ u003d 22,4 m 3 66 / 44,8 \u003d X / 22,4 X \u003d 66 22,4 / 44,8 \u003d 33 m 3 alebo 2 V (CO) / V (O 2) \u003d / V 0 (CO) ) V - molárne objemy V 0 - vypočítané objemy V 0 (O 2) \u003d V (O 2) (V 0 (CO) / 2 V (CO))
Úloha 7 . Ako sa zmení tlak v nádobe naplnenej plynným vodíkom a chlórom po ich reakcii? Podobne pre vodík a kyslík?
Riešenie:
- H2 + Cl2 \u003d 2HCl - v dôsledku interakcie 1 mol vodíka a 1 mol chlóru sa získajú 2 mol chlorovodíka: 1 (mol) + 1 (mol) \u003d 2 (mol), preto sa tlak nezmení, pretože výsledný objem plynnej zmesi je súčtom objemov zložiek zapojených do reakcie.
- 2H 2 + O 2 \u003d 2H 2 O - 2 (mol) + 1 (mol) \u003d 2 (mol) - tlak v nádobe sa zníži jeden a pol krát, pretože sa získali 2 objemy zmesi plynov z 3 objemov zložiek, ktoré vstúpili do reakcie.
Úloha 8. 12 litrov plynnej zmesi čpavku a štvormocného oxidu uhoľnatého v n.o.s. majú hmotnosť 18 g. Koľko je v zmesi každého z plynov?
Riešenie:
V(NH3)=xl V(C02)=yl M(NH3)=14+13=17 g/mol M(C02)=12+16 2=44 g/mol m(NH3) \ u003d x / (22,4 17) g m (CO 2) \u003d y / (22,4 44) g Systém rovníc objem zmesi: x + y \u003d 12 hmotnosť zmesi: x / (22,4 ) 17)+y/(22,4 44) =18 Po vyriešení dostaneme: x=4,62 l y=7,38 l
Úloha 9. Koľko vody sa získa reakciou 2 g vodíka a 24 g kyslíka.
Riešenie:
2H2+02 \u003d 2H20
Z reakčnej rovnice je vidieť, že počet reaktantov nezodpovedá pomeru stechiometrických koeficientov v rovnici. V takýchto prípadoch sa výpočty vykonávajú na látke, ktorej je menej, t. j. táto látka skončí ako prvá v priebehu reakcie. Ak chcete určiť, ktorá zo zložiek je nedostatková, musíte venovať pozornosť koeficientu v reakčnej rovnici.
Množstvá východiskových zložiek ν(H 2)=4/2=2 (mol) ν(O 2)=48/32=1,5 (mol)
Netreba sa však ponáhľať. V našom prípade sú na reakciu s 1,5 mólom kyslíka potrebné 3 móly vodíka (1,5 2) a máme ho len 2 móly, t.j. 1 mól vodíka nestačí na celý jeden a pol mólu kyslík reagovať. Preto vypočítame množstvo vody vodíkom:
ν (H 2 O) \u003d ν (H 2) \u003d 2 mol m (H 2 O) \u003d 2 18 \u003d 36 g
Úloha 10. Pri teplote 400 K a tlaku 3 atmosféry zaberá plyn objem 1 liter. Aký objem bude tento plyn zaberať v n.o.s.?
Riešenie:
Z Clapeyronovej rovnice:
P V/T = P n V n /T n V n = (PVT n)/(P n T) V n = (3 1 273)/(1 400) = 2,05 l
Názvy kyselín sú tvorené z ruského názvu centrálneho atómu kyseliny s pridaním prípon a koncoviek. Ak oxidačný stav centrálneho atómu kyseliny zodpovedá číslu skupiny periodickej sústavy, potom sa názov tvorí pomocou najjednoduchšieho prídavného mena z názvu prvku: H 2 SO 4 - kyselina sírová, HMnO 4 - kyselina mangánová . Ak kyselinotvorné prvky majú dve oxidačné stavy, potom sa stredný oxidačný stav označuje príponou -ist-: H 2 SO 3 - kyselina sírová, HNO 2 - kyselina dusitá. Pre názvy halogénových kyselín s mnohými oxidačnými stavmi sa používajú rôzne prípony: typické príklady - HClO 4 - chlór n kyselina, HClO 3 - chlór novovať kyselina, HClO 2 - chlór ist kyselina, HClO - chlór novátor kyselina (anoxická kyselina HCl sa nazýva kyselina chlorovodíková - zvyčajne kyselina chlorovodíková). Kyseliny sa môžu líšiť v počte molekúl vody, ktoré hydratujú oxid. Kyseliny obsahujúce najväčší počet atómov vodíka sa nazývajú ortokyseliny: H 4 SiO 4 - kyselina ortokremičitá, H 3 PO 4 - kyselina fosforečná. Kyseliny obsahujúce 1 alebo 2 atómy vodíka sa nazývajú metakyseliny: H 2 SiO 3 - kyselina metakremičitá, HPO 3 - kyselina metafosforečná. Kyseliny obsahujúce dva centrálne atómy sa nazývajú di kyseliny: H 2 S 2 O 7 - kyselina disírová, H 4 P 2 O 7 - kyselina difosforečná.
Názvy komplexných zlúčenín sa tvoria rovnakým spôsobom ako názvy solí, ale komplexný katión alebo anión má systematický názov, to znamená, že sa číta sprava doľava: K 3 - hexafluoroželezitan draselný (III), SO 4 - tetraammín meďnatý (II) síran.
Názvy oxidov sú tvorené pomocou slova „oxid“ a genitívu ruského názvu centrálneho atómu oxidu, ktorý v prípade potreby označuje stupeň oxidácie prvku: Al 2 O 3 - oxid hlinitý, Fe 2 O 3 - oxid železa (III).
Základné mená sa tvoria pomocou slova "hydroxid" a genitívu ruského názvu centrálneho atómu hydroxidu, ktorý v prípade potreby označuje stupeň oxidácie prvku: Al (OH) 3 - hydroxid hlinitý, Fe (OH) 3 - hydroxid železitý.
Názvy zlúčenín s vodíkom vznikajú v závislosti od acidobázických vlastností týchto zlúčenín. Pre plynné kyselinotvorné zlúčeniny s vodíkom sa používajú názvy: H 2 S - sulfán (sírovodík), H 2 Se - selán (selenovodík), HI - jódovodík; ich roztoky vo vode sa nazývajú sulfidové, hydroselénové a jodovodíkové kyseliny. Pre niektoré zlúčeniny s vodíkom sa používajú špeciálne názvy: NH 3 - amoniak, N 2 H 4 - hydrazín, PH 3 - fosfín. Zlúčeniny s vodíkom s oxidačným stavom –1 sa nazývajú hydridy: NaH je hydrid sodný, CaH2 je hydrid vápenatý.
Názvy solí vznikajú z latinského názvu centrálneho atómu zvyšku kyseliny s pridaním predpôn a prípon. Názvy binárnych (dvojprvkových) solí sa tvoria pomocou prípony - id: NaCl - chlorid sodný, Na 2 S - sulfid sodný. Ak má centrálny atóm zvyšku kyseliny obsahujúcej kyslík dva kladné oxidačné stavy, potom najvyšší oxidačný stav je označený príponou - pri: Na2S04 - sulf pri sodík, KNO 3 - dus pri draslík a najnižší oxidačný stav - prípona - to: Na2S03 - sulf to sodík, KNO 2 - dus to draslík. Pre názov solí halogénov obsahujúcich kyslík sa používajú predpony a prípony: KClO 4 - pruh chlór pri draslík, Mg (ClO 3) 2 - chlór pri horčík, KClO 2 - chlór to draslík, KClO - hypo chlór to draslík.
Sýtosť kovalentnásspojeniejej- sa prejavuje tým, že v zlúčeninách s- a p-prvkov nie sú nespárované elektróny, to znamená, že všetky nespárované elektróny atómov tvoria väzbové elektrónové páry (výnimkou sú NO, NO 2, ClO 2 a ClO 3).
Osamelé elektrónové páry (LEP) sú elektróny, ktoré obsadzujú atómové orbitály v pároch. Prítomnosť NEP určuje schopnosť aniónov alebo molekúl tvoriť donor-akceptorové väzby ako donory elektrónových párov.
Nespárované elektróny - elektróny atómu, obsiahnuté jeden po druhom v orbitáli. Pre s- a p-prvky počet nespárovaných elektrónov určuje, koľko väzbových elektrónových párov môže daný atóm vytvoriť s inými atómami mechanizmom výmeny. Metóda valenčnej väzby predpokladá, že počet nespárovaných elektrónov sa môže zvýšiť nezdieľanými elektrónovými pármi, ak sú na valenčnej elektronickej úrovni prázdne orbitály. Vo väčšine zlúčenín s- a p-prvkov nie sú žiadne nepárové elektróny, pretože všetky nespárované elektróny atómov tvoria väzby. Existujú však molekuly s nespárovanými elektrónmi, napríklad NO, NO 2, sú vysoko reaktívne a majú tendenciu vytvárať diméry typu N 2 O 4 v dôsledku nespárovaných elektrónov.
Normálna koncentrácia - je počet krtkov ekvivalenty v 1 litri roztoku.
Normálne podmienky - teplota 273K (0 o C), tlak 101,3 kPa (1 atm).
Výmenné a donor-akceptorové mechanizmy tvorby chemickej väzby. Tvorba kovalentných väzieb medzi atómami môže prebiehať dvoma spôsobmi. Ak k vytvoreniu väzbového elektrónového páru dôjde v dôsledku nespárovaných elektrónov oboch viazaných atómov, potom sa tento spôsob vytvorenia väzbového elektrónového páru nazýva výmenný mechanizmus - atómy si vymieňajú elektróny, navyše väzbové elektróny patria obom viazaným atómom . Ak je väzbový elektrónový pár vytvorený v dôsledku osamelého elektrónového páru jedného atómu a prázdneho orbitálu iného atómu, potom je takáto tvorba väzbového elektrónového páru mechanizmom donor-akceptor (pozri obr. metóda valenčnej väzby).
Reverzibilné iónové reakcie - sú to reakcie, pri ktorých vznikajú produkty, ktoré sú schopné tvoriť východiskové látky (ak máme na pamäti napísanú rovnicu, tak o reverzibilných reakciách môžeme povedať, že môžu prebiehať oboma smermi za vzniku slabých elektrolytov alebo slabo rozpustných zlúčenín) . Reverzibilné iónové reakcie sú často charakterizované neúplnou konverziou; keďže počas reverzibilnej iónovej reakcie vznikajú molekuly alebo ióny, ktoré spôsobujú posun smerom k počiatočným reakčným produktom, čiže reakciu akoby „spomalia“. Reverzibilné iónové reakcie sú opísané znakom ⇄ a ireverzibilné reakcie sú opísané znakom →. Príkladom reverzibilnej iónovej reakcie je reakcia H 2 S + Fe 2+ ⇄ FeS + 2H + a príkladom ireverzibilnej reakcie je S 2- + Fe 2+ → FeS.
Oxidačné činidlá – látky, v ktorých pri redoxných reakciách klesajú oxidačné stavy niektorých prvkov.
Redoxná dualita - schopnosť látok pôsobiť redoxné reakcie ako oxidačné činidlo alebo redukčné činidlo, v závislosti od partnera (napríklad H 2 O 2, NaNO 2).
Redoxné reakcie(OVR) - Ide o chemické reakcie, pri ktorých sa menia oxidačné stavy prvkov reaktantov.
Redoxný potenciál - hodnota, ktorá charakterizuje redoxnú schopnosť (pevnosť) oxidačného činidla aj redukčného činidla, ktoré tvoria zodpovedajúcu polovičnú reakciu. Redoxný potenciál páru Cl2/Cl - rovný 1,36 V teda charakterizuje molekulárny chlór ako oxidačné činidlo a chloridový ión ako redukčné činidlo.
Oxidy - zlúčeniny prvkov s kyslíkom, v ktorých má kyslík oxidačný stav -2.
Orientačné interakcie– medzimolekulové interakcie polárnych molekúl.
Osmóza - fenomén prenosu molekúl rozpúšťadla na semipermeabilnú (len pre rozpúšťadlo) membránu smerom k nižšej koncentrácii rozpúšťadla.
Osmotický tlak - fyzikálno-chemická vlastnosť roztokov v dôsledku schopnosti membrán prepúšťať iba molekuly rozpúšťadla. Osmotický tlak zo strany menej koncentrovaného roztoku vyrovnáva rýchlosti prieniku molekúl rozpúšťadla na oboch stranách membrány. Osmotický tlak roztoku sa rovná tlaku plynu, v ktorom je koncentrácia molekúl rovnaká ako koncentrácia častíc v roztoku.
Základy podľa Arrhenia - látky, ktoré v procese elektrolytickej disociácie odštiepujú hydroxidové ióny.
Základy podľa Bronsteda - zlúčeniny (molekuly alebo ióny ako S2-, HS-), ktoré môžu pripojiť vodíkové ióny.
základy podľa Lewisa (základne Lewis) – zlúčeniny (molekuly alebo ióny) s nezdieľanými elektrónovými pármi schopnými vytvárať väzby donor-akceptor. Najbežnejšou Lewisovou bázou sú molekuly vody, ktoré majú silné donorové vlastnosti.
V chémii sa nepoužívajú hodnoty absolútnej hmotnosti molekúl, ale hodnota relatívnej molekulovej hmotnosti. Ukazuje, koľkokrát je hmotnosť molekuly väčšia ako 1/12 hmotnosti atómu uhlíka. Táto hodnota je označená M r .
Relatívna molekulová hmotnosť sa rovná súčtu relatívnych atómových hmotností jej jednotlivých atómov. Vypočítajte relatívnu molekulovú hmotnosť vody.
Viete, že molekula vody obsahuje dva atómy vodíka a jeden atóm kyslíka. Potom sa jeho relatívna molekulová hmotnosť bude rovnať súčtu súčinov relatívnej atómovej hmotnosti každého chemického prvku a počtu jeho atómov v molekule vody:
Keď poznáme relatívne molekulové hmotnosti plynných látok, je možné porovnať ich hustoty, t.j. vypočítať relatívnu hustotu jedného plynu od druhého - D (A / B). Relatívna hustota plynu A pre plyn B sa rovná pomeru ich relatívnych molekulových hmotností:

Vypočítajte relatívnu hustotu oxidu uhličitého pre vodík:
Teraz vypočítame relatívnu hustotu oxidu uhličitého pre vodík:
D(ko.g./vodík.) = Mr (ko.g.): Mr (vodík.) = 44:2 = 22.
Oxid uhličitý je teda 22-krát ťažší ako vodík.
Ako viete, Avogadrov zákon sa vzťahuje len na plynné látky. Chemici však musia mať predstavu o počte molekúl a podieloch kvapalných alebo pevných látok. Preto na porovnanie počtu molekúl v látkach zaviedli chemici hodnotu - molárna hmota .
Molárna hmotnosť je označená M, je číselne rovná relatívnej molekulovej hmotnosti.
Pomer hmotnosti látky k jej molárnej hmotnosti sa nazýva množstvo hmoty .
Množstvo látky je označené n. Toto je kvantitatívna charakteristika časti látky spolu s hmotnosťou a objemom. Množstvo látky sa meria v móloch.

Slovo "krtek" pochádza zo slova "molekula". Počet molekúl v rovnakých množstvách látky je rovnaký.
Experimentálne sa zistilo, že 1 mol látky obsahuje častice (napríklad molekuly). Toto číslo sa nazýva Avogadrovo číslo. A ak k tomu pridáte mernú jednotku - 1 / mol, potom to bude fyzikálna veličina - Avogadroova konštanta, ktorá sa označuje N A.
Molárna hmotnosť sa meria v g/mol. Fyzikálny význam molárnej hmotnosti je, že táto hmotnosť je 1 mól látky.
Podľa Avogadrovho zákona 1 mol akéhokoľvek plynu zaberie rovnaký objem. Objem jedného mólu plynu sa nazýva molárny objem a označuje sa V n .
Za normálnych podmienok (a to je 0 ° C a normálny tlak - 1 atm. Alebo 760 mm Hg alebo 101,3 kPa) je molárny objem 22,4 l / mol.
Potom množstvo plynnej látky pri n.o. možno vypočítať ako pomer objemu plynu k molárnemu objemu.

ÚLOHA 1. Aké množstvo látky zodpovedá 180 g vody?

ÚLOHA 2. Vypočítajme objem pri n.o., ktorý bude zaberať oxid uhličitý v množstve 6 mol.

Bibliografia
- Zbierka úloh a cvičení z chémie: 8. ročník: k učebnici P.A. Orzhekovsky a ďalší. "Chémia, 8. ročník" / P.A. Oržekovskij, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006. (s. 29-34)
- Ushakova O.V. Pracovný zošit z chémie: 8. ročník: k učebnici P.A. Oržekovskij a ďalší.„Chémia. Stupeň 8” / O.V. Ushakova, P.I. Bespalov, P.A. Oržekovskij; pod. vyd. Prednášal prof. P.A. Oržekovskij - M.: AST: Astrel: Profizdat, 2006. (s. 27-32)
- Chémia: 8. ročník: učebnica. pre všeobecné inštitúcie / P.A. Oržekovskij, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§§ 12, 13)
- Chémia: inorg. chémia: učebnica. pre 8 buniek. všeobecná inštitúcia / G.E. Rudzitis, F.G. Feldman. - M .: Vzdelávanie, JSC "Moskva učebnice", 2009. (§§ 10, 17)
- Encyklopédia pre deti. Zväzok 17. Chémia / Kapitola. upravil V.A. Volodin, vedúci. vedecký vyd. I. Leenson. - M.: Avanta +, 2003.
- Jedna zbierka digitálnych vzdelávacích zdrojov ().
- Elektronická verzia časopisu "Chémia a život" ().
- Testy z chémie (online) ().
Domáca úloha
1.str. 69 č. 3; str.73 č. 1, 2, 4 z učebnice "Chémia: 8. ročník" (P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M .: AST: Astrel, 2005).
2. №№ 65, 66, 71, 72 zo Zbierka úloh a cvičení z chémie: 8. ročník: k učebnici P.A. Orzhekovsky a ďalší. "Chémia, 8. ročník" / P.A. Oržekovskij, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006.
Spolu s hmotnosťou a objemom v chemických výpočtoch sa často používa množstvo látky, ktoré je úmerné počtu štruktúrnych jednotiek obsiahnutých v látke. V tomto prípade musí byť v každom prípade uvedené, ktoré štruktúrne jednotky (molekuly, atómy, ióny atď.) sú myslené. Jednotkou množstva látky je mol.
Mol je množstvo látky obsahujúcej toľko molekúl, atómov, iónov, elektrónov alebo iných štruktúrnych jednotiek, koľko je atómov v 12 g izotopu uhlíka 12C.
Počet štruktúrnych jednotiek obsiahnutých v 1 mole látky (Avogadrova konštanta) sa určuje s veľkou presnosťou; v praktických výpočtoch sa berie ako rovný 6,02 1024 mol -1.
Je ľahké ukázať, že hmotnosť 1 mólu látky (mólová hmotnosť), vyjadrená v gramoch, sa číselne rovná relatívnej molekulovej hmotnosti tejto látky.
Relatívna molekulová hmotnosť (alebo skrátene molekulová hmotnosť) voľného chlóru C1r je teda 70,90. Preto je molárna hmotnosť molekulárneho chlóru 70,90 g/mol. Molárna hmotnosť atómov chlóru je však polovičná (45,45 g/mol), keďže 1 mól molekúl chlóru Cl obsahuje 2 móly atómov chlóru.
Podľa Avogadrovho zákona rovnaké objemy všetkých plynov odoberaných pri rovnakej teplote a rovnakom tlaku obsahujú rovnaký počet molekúl. Inými slovami, rovnaký počet molekúl akéhokoľvek plynu zaberá rovnaký objem za rovnakých podmienok. Avšak 1 mol akéhokoľvek plynu obsahuje rovnaký počet molekúl. Preto za rovnakých podmienok 1 mól akéhokoľvek plynu zaberá rovnaký objem. Tento objem sa nazýva molárny objem plynu a za normálnych podmienok (0 °C, tlak 101, 425 kPa) je 22,4 litra.
Napríklad výrok „obsah oxidu uhličitého vo vzduchu je 0,04 % (obj.)“ znamená, že pri parciálnom tlaku CO 2 rovnajúcom sa tlaku vzduchu a pri rovnakej teplote bude oxid uhličitý obsiahnutý vo vzduchu odobrať 0,04 % z celkového objemu obsadeného vzduchom.
Kontrolná úloha
1. Porovnajte počty molekúl obsiahnutých v 1 g NH 4 a 1 g N 2. V akom prípade a koľkokrát je počet molekúl väčší?
2. Vyjadrite hmotnosť jednej molekuly oxidu siričitého v gramoch.
4. Koľko molekúl obsahuje 5,00 ml chlóru za normálnych podmienok?
4. Aký objem za normálnych podmienok zaberá 27 10 21 molekúl plynu?
5. Vyjadrite hmotnosť jednej molekuly NO 2 v gramoch -
6. Aký je pomer objemov, ktoré zaberá 1 mól O 2 a 1 mól Oz (podmienky sú rovnaké)?
7. Rovnaké množstvá kyslíka, vodíka a metánu sa odoberajú za rovnakých podmienok. Nájdite pomer objemov odobratých plynov.
8. Na otázku, aký objem zaberie 1 mol vody za normálnych podmienok, prišla odpoveď: 22,4 litra. Je toto správna odpoveď?
9. Vyjadrite hmotnosť jednej molekuly HCl v gramoch.
Koľko molekúl oxidu uhličitého je v 1 litri vzduchu, ak objemový obsah CO 2 je 0,04 % (normálne podmienky)?
10. Koľko mólov je obsiahnutých v 1 m 4 akéhokoľvek plynu za normálnych podmienok?
11. Vyjadrite v gramoch hmotnosť jednej molekuly H 2 O-
12. Koľko mólov kyslíka je v 1 litri vzduchu, ak objem
14. Koľko mólov dusíka je v 1 litri vzduchu, ak jeho objemový obsah je 78 % (normálne podmienky)?
14. Rovnaké množstvá kyslíka, vodíka a dusíka sa odoberajú za rovnakých podmienok. Nájdite pomer objemov odobratých plynov.
15. Porovnaj počty molekúl obsiahnutých v 1 g NO 2 a 1 g N 2. V akom prípade a koľkokrát je počet molekúl väčší?
16. Koľko molekúl obsahuje 2,00 ml vodíka za normálnych podmienok?
17. Vyjadrite v gramoch hmotnosť jednej molekuly H 2 O-
18. Aký objem za normálnych podmienok zaberá 17 10 21 molekúl plynu?
RÝCHLOSŤ CHEMICKÝCH REAKCIÍ
Pri definovaní pojmu rýchlosť chemickej reakcie je potrebné rozlišovať medzi homogénnymi a heterogénnymi reakciami. Ak reakcia prebieha v homogénnom systéme, napríklad v roztoku alebo v zmesi plynov, tak prebieha v celom objeme systému. Rýchlosť homogénnej reakcie nazývané množstvo látky, ktoré vstúpi do reakcie alebo sa vytvorí ako výsledok reakcie za jednotku času v jednotkovom objeme systému. Keďže pomer počtu mólov látky k objemu, v ktorom je distribuovaná, je molárna koncentrácia látky, rýchlosť homogénnej reakcie možno definovať aj ako zmena koncentrácie za jednotku času ktorejkoľvek z látok: počiatočného činidla alebo reakčného produktu. Aby bol výsledok výpočtu vždy kladný, bez ohľadu na to, či je produkovaný činidlom alebo produktom, vo vzorci sa používa znamienko „±“:
V závislosti od charakteru reakcie môže byť čas vyjadrený nielen v sekundách, ako to vyžaduje sústava SI, ale aj v minútach alebo hodinách. Počas reakcie nie je hodnota jeho rýchlosti konštantná, ale neustále sa mení: klesá, pretože koncentrácie východiskových látok klesajú. Uvedený výpočet udáva priemernú hodnotu rýchlosti reakcie za určitý časový interval Δτ = τ 2 – τ 1 . Skutočná (okamžitá) rýchlosť je definovaná ako hranica, do ktorej je pomer Δ OD/ Δτ pri Δτ → 0, t.j. skutočná rýchlosť sa rovná časovej derivácii koncentrácie.
Pre reakciu, ktorej rovnica obsahuje stechiometrické koeficienty, ktoré sa líšia od jednoty, nie sú hodnoty rýchlosti vyjadrené pre rôzne látky rovnaké. Napríklad pre reakciu A + 4B \u003d D + 2E je spotreba látky A jeden mól, látka B sú tri móly, príchod látky E sú dva móly. Preto υ (A) = ⅓ υ (B) = υ (D) = ½ υ (E) alebo υ (E). = ⅔ υ (AT) .
Ak prebieha reakcia medzi látkami, ktoré sú v rôznych fázach heterogénneho systému, potom môže prebiehať len na rozhraní medzi týmito fázami. Napríklad k interakcii roztoku kyseliny a kúska kovu dochádza iba na povrchu kovu. Rýchlosť heterogénnej reakcie nazývané množstvo látky, ktoré vstúpi do reakcie alebo sa vytvorí ako výsledok reakcie za jednotku času na jednotku rozhrania medzi fázami:
 .
.
Závislosť rýchlosti chemickej reakcie od koncentrácie reaktantov vyjadruje zákon o pôsobení hmoty: pri konštantnej teplote je rýchlosť chemickej reakcie priamo úmerná súčinu molárnych koncentrácií reaktantov zvýšených na mocniny rovné koeficientom vo vzorcoch týchto látok v reakčnej rovnici. Potom k reakcii
2A + B → výrobky
pomer υ ~ · OD A 2 OD B a pre prechod na rovnosť sa zavádza koeficient proporcionality k, volal konštanta reakčnej rýchlosti:
υ = k· OD A 2 OD B = k[A] 2 [V]
(molárne koncentrácie vo vzorcoch možno označiť ako písmeno OD so zodpovedajúcim indexom a vzorcom látky uzavretým v hranatých zátvorkách). Fyzikálny význam rýchlostnej konštanty reakcie je rýchlosť reakcie pri koncentráciách všetkých reaktantov rovných 1 mol/l. Rozmer konštanty reakčnej rýchlosti závisí od počtu faktorov na pravej strane rovnice a môže byť od -1; s –1 (l/mol); s –1 (l 2 / mol 2) atď., to znamená tak, že v každom prípade je rýchlosť reakcie vo výpočtoch vyjadrená v mol l –1 s –1.
Pre heterogénne reakcie rovnica zákona o pôsobení hmoty zahŕňa koncentrácie len tých látok, ktoré sú v plynnej fáze alebo v roztoku. Koncentrácia látky v tuhej fáze je konštantná hodnota a započítava sa do rýchlostnej konštanty, napríklad pre spaľovací proces uhlia C + O 2 = CO 2 platí zákon o pôsobení hmoty:
υ = kI const = k·,
kde k= kI konšt.
V systémoch, kde jedna alebo viacero látok sú plyny, závisí rýchlosť reakcie aj od tlaku. Napríklad, keď vodík interaguje s parami jódu H2 + I2 \u003d 2HI, rýchlosť chemickej reakcie bude určená výrazom:
υ = k··.
Ak sa tlak zvýši napríklad 4-krát, potom sa objem zaberaný systémom zníži o rovnaké množstvo a následne sa koncentrácia každej z reagujúcich látok zvýši o rovnaké množstvo. Rýchlosť reakcie sa v tomto prípade zvýši 9-krát
Teplotná závislosť rýchlosti reakcie je opísaná van't Hoffovým pravidlom: pri každom zvýšení teploty o 10 stupňov sa rýchlosť reakcie zvýši 2-4 krát. To znamená, že keď teplota exponenciálne rastie, rýchlosť chemickej reakcie sa zvyšuje exponenciálne. Základom vo vzorci postupu je reakčná rýchlosť teplotný koeficientγ, ktorá ukazuje, koľkokrát sa rýchlosť danej reakcie zvýši (alebo, čo je to isté, rýchlostná konštanta) so zvýšením teploty o 10 stupňov. Matematicky je van't Hoffovo pravidlo vyjadrené vzorcami:
 alebo
alebo 
kde a sú reakčné rýchlosti na začiatku t 1 a konečná t 2 teploty. Van't Hoffovo pravidlo možno vyjadriť aj takto:
![]() ;
;  ;
; ![]() ;
;  ,
,
kde a sú rýchlosť a rýchlostná konštanta reakcie pri teplote t; a sú rovnaké hodnoty pri teplote t +10n; n je počet „desaťstupňových“ intervalov ( n =(t 2 –t 1)/10), o ktoré sa zmenila teplota (môže to byť celé číslo alebo zlomkové číslo, kladné alebo záporné).
Kontrolná úloha
1. Nájdite hodnotu rýchlostnej konštanty reakcie A + B -> AB, ak pri koncentráciách látok A a B rovných 0,05 a 0,01 mol / l je rýchlosť reakcie 5 10 -5 mol / (l-min. ).
2. Koľkokrát sa zmení rýchlosť reakcie 2A + B -> A2B, ak sa koncentrácia látky A zvýši 2-krát a koncentrácia látky B sa zníži 2-krát?
4. Koľkokrát by sa mala zvýšiť koncentrácia látky, B 2 v systéme 2A 2 (g.) + B 2 (g.) \u003d 2A 2 B (g.), Takže keď koncentrácia látky A sa zníži 4-krát, rýchlosť priamej reakcie sa nemení ?
4. Po určitom čase od začiatku reakcie 3A + B-> 2C + D boli koncentrácie látok: [A] = 0,04 mol/l; [B] = 0,01 mol/l; [C] \u003d 0,008 mol/l. Aké sú počiatočné koncentrácie látok A a B?
5. V systéme CO + C1 2 = COC1 2 sa koncentrácia zvýšila z 0,04 na 0,12 mol / l a koncentrácia chlóru - z 0,02 na 0,06 mol / l. O koľko sa zvýšila rýchlosť doprednej reakcie?
6. Reakcia medzi látkami A a B je vyjadrená rovnicou: A + 2B → C. Počiatočné koncentrácie sú: [A] 0 \u003d 0,04 mol / l, [B] o \u003d 0,05 mol / l. Konštanta reakčnej rýchlosti je 0,4. Nájdite počiatočnú rýchlosť reakcie a rýchlosť reakcie po určitom čase, keď koncentrácia látky A klesne o 0,01 mol/l.
7. Ako sa zmení rýchlosť reakcie 2СО + О2 = 2СО2 prebiehajúca v uzavretej nádobe, ak sa tlak zdvojnásobí?
8. Vypočítajte, koľkokrát sa rýchlosť reakcie zvýši, ak sa teplota systému zvýši z 20 °C na 100 °C, za predpokladu, že teplotný koeficient rýchlosti reakcie je 4.
9. Ako sa zmení rýchlosť reakcie 2NO(r.) + 0 2 (g.) → 2N02 (r.) ak sa tlak v systéme zvýši 4-krát;
10. Ako sa zmení rýchlosť reakcie 2NO(r.) + 0 2 (g.) → 2N02 (r.) ak sa objem systému zmenší 4-krát?
11. Ako sa zmení rýchlosť reakcie 2NO(r.) + 0 2 (g.) → 2N02 (r.) ak sa koncentrácia NO zvýši 4-krát?
12. Aký je teplotný koeficient rýchlosti reakcie, ak pri zvýšení teploty o 40 st.
vzrastie 15,6 krát?
štrnásť.. Nájdite hodnotu rýchlostnej konštanty reakcie A + B -> AB, ak pri koncentráciách látok A a B rovných 0,07 a 0,09 mol/l je rýchlosť reakcie 2,7 10 -5 mol / (l-min).
14. Reakcia medzi látkami A a B je vyjadrená rovnicou: A + 2B → C. Počiatočné koncentrácie sú: [A] 0 \u003d 0,01 mol / l, [B] o \u003d 0,04 mol / l. Konštanta reakčnej rýchlosti je 0,5. Nájdite počiatočnú rýchlosť reakcie a rýchlosť reakcie po určitom čase, keď koncentrácia látky A klesne o 0,01 mol/l.
15. Ako sa zmení rýchlosť reakcie 2NO(r.) + 0 2 (g.) → 2N02 (r.) ak sa tlak v systéme zdvojnásobí;
16. V systéme CO + C1 2 = COC1 2 sa koncentrácia zvýšila z 0,05 na 0,1 mol / l a koncentrácia chlóru - z 0,04 na 0,06 mol / l. O koľko sa zvýšila rýchlosť doprednej reakcie?
17. Vypočítajte, koľkokrát sa zvýši rýchlosť reakcie, ak sa teplota systému zvýši z 20 °C na 80 °C, za predpokladu, že hodnota teplotného koeficientu rýchlosti reakcie je 2.
18. Vypočítajte, koľkokrát sa rýchlosť reakcie zvýši, ak sa teplota systému zvýši zo 40 °C na 90 °C, za predpokladu, že hodnota teplotného koeficientu rýchlosti reakcie je 4.
CHEMICKÁ VÄZBA. VZNIK A ŠTRUKTÚRA MOLEKÚL
1. Aké typy chemických väzieb poznáte? Uveďte príklad vzniku iónovej väzby metódou valenčných väzieb.
2. Aká chemická väzba sa nazýva kovalentná? Čo je charakteristické pre kovalentný typ väzby?
4. Aké vlastnosti charakterizuje kovalentná väzba? Ukážte to na konkrétnych príkladoch.
4. Aký typ chemickej väzby v molekulách H 2; Cl2HC1?
5. Aký je charakter väzieb v molekulách NCI 4, CS2, CO2? Pre každý z nich uveďte smer posunu spoločného elektrónového páru.
6. Aká chemická väzba sa nazýva iónová? Čo je charakteristické pre iónovú väzbu?
7. Aký typ väzby je v molekulách NaCl, N 2, Cl 2?
8. Nakreslite všetky možné spôsoby prekrytia s-orbitálu s p-orbitálom;. V tomto prípade špecifikujte smer pripojenia.
9. Vysvetlite donor-akceptorový mechanizmus kovalentnej väzby na príklade tvorby fosfóniového iónu [РН 4 ]+.
10. V molekulách CO, CO 2 je väzba polárna alebo nepolárna? Vysvetlite. Opíšte vodíkovú väzbu.
11. Prečo sú niektoré molekuly, ktoré majú polárne väzby, vo všeobecnosti nepolárne?
12. Kovalentný alebo iónový typ väzby je typický pre nasledujúce zlúčeniny: Nal, S0 2, KF? Prečo je iónová väzba limitujúcim prípadom kovalentnej väzby?
14. Čo je to kovová väzba? Ako sa líši od kovalentnej väzby? Aké vlastnosti kovov spôsobuje?
14. Aký je charakter väzieb medzi atómami v molekulách; KHF2, H20, HNO ?
15. Ako vysvetliť vysokú pevnosť väzby medzi atómami v molekule dusíka N 2 a oveľa nižšiu pevnosť v molekule fosforu P 4?
16. Čo je vodíková väzba? Prečo nie je tvorba vodíkových väzieb typická pre molekuly H2S a HC1, na rozdiel od H2O a HF?
17. Aká väzba sa nazýva iónová? Má iónová väzba vlastnosti sýtosti a smerovosti? Prečo je to obmedzujúci prípad kovalentnej väzby?
18. Aký typ väzby je v molekulách NaCl, N 2, Cl 2?