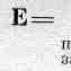Lectia 1.
Subiect: Cantitatea de substanță. cârtiță
Chimia este știința substanțelor. Cum măsurați substanțele? In ce unitati? În moleculele care alcătuiesc substanțele, dar acest lucru este foarte greu de făcut. În grame, kilograme sau miligrame, dar așa se măsoară masa. Dar dacă combinăm masa măsurată pe cântare și numărul de molecule ale unei substanțe, este posibil acest lucru?
a) H-hidrogen
A n = 1a.u.m.
1a.u.m = 1,66 * 10 -24 g
Să luăm 1 g de hidrogen și să calculăm numărul de atomi de hidrogen din această masă (oferiți elevilor să facă acest lucru folosind un calculator).
N n \u003d 1g / (1,66 * 10 -24) g \u003d 6,02 * 10 23
b) O-oxigen
A o \u003d 16a.u.m \u003d 16 * 1,67 * 10 -24 g
N o \u003d 16g / (16 * 1,66 * 10 -24) g \u003d 6,02 * 10 23
c) C-carbon
A c \u003d 12a.u.m \u003d 12 * 1,67 * 10 -24 g
N c \u003d 12g / (12 * 1,66 * 10 -24) g \u003d 6,02 * 10 23
Să conchidem: dacă luăm o astfel de masă a unei substanțe care este egală cu masa atomică ca mărime, dar luată în grame, atunci vor exista întotdeauna (pentru orice substanță) 6,02 * 10 23 de atomi ai acestei substanțe.
H2O - apă
18g / (18 * 1,66 * 10 -24) g \u003d 6,02 * 10 23 de molecule de apă etc.
N a \u003d 6,02 * 10 23 - numărul sau constanta lui Avogadro.
Mol - cantitatea unei substanțe care conține 6,02 * 10 23 molecule, atomi sau ioni, adică. unități structurale.
Există un mol de molecule, un mol de atomi, un mol de ioni.
n este numărul de moli, (numărul de moli este adesea denumit nu),
N este numărul de atomi sau molecule,
N a = constanta lui Avogadro.
Kmol \u003d 10 3 mol, mmol \u003d 10 -3 mol.
Afișați un portret al lui Amedeo Avogadro pe o instalație multimedia și vorbiți pe scurt despre el sau instruiți studentul să pregătească un scurt raport despre viața unui om de știință.
Lectia 2
Subiectul „Masa molară a materiei”
Care este masa unui mol de substanță? (Elevii pot trage adesea singuri concluzia.)
Masa unui mol dintr-o substanță este egală cu greutatea sa moleculară, dar exprimată în grame. Masa unui mol dintr-o substanță se numește masă molară și se notează - M.
Formule:
M - masa molara,
n este numărul de moli,
m este masa substanței.
Masa unui mol se măsoară în g/mol, masa unui kmol se măsoară în kg/kmol, iar masa unui mmol se măsoară în mg/mol.
Completați tabelul (tabelele sunt distribuite).
Substanţă |
Numărul de molecule |
Masă molară |
Numărul de alunițe |
Masa de materie |
5 mol |
||||
H2S04 |
||||
12 ,0 4*10 26 |
Lecția 3
Subiect: Volumul molar al gazelor
Să rezolvăm problema. Determinați volumul de apă, a cărui masă în condiții normale este de 180 g.
Dat:
Acestea. volumul corpurilor lichide și solide se calculează prin densitate.
Dar, atunci când se calculează volumul de gaze, nu este necesar să se cunoască densitatea. De ce?
Omul de știință italian Avogadro a stabilit că volume egale de gaze diferite în aceleași condiții (presiune, temperatură) conțin același număr de molecule - această afirmație se numește legea lui Avogadro.
Acestea. dacă în condiții egale V (H 2) \u003d V (O 2), atunci n (H 2) \u003d n (O 2) și invers, dacă în condiții egale n (H 2) \u003d n (O 2) ) atunci volumele acestor gaze vor fi aceleași. Și un mol dintr-o substanță conține întotdeauna același număr de molecule 6,02 * 10 23 .
Încheiem - în aceleași condiții, molii de gaze ar trebui să ocupe același volum.
În condiții normale (t=0, P=101,3 kPa sau 760 mm Hg), molii de orice gaz ocupă același volum. Acest volum se numește molar.
V m \u003d 22,4 l / mol
1 kmol ocupă un volum de -22,4 m 3 / kmol, 1 mmol ocupă un volum de -22,4 ml / mmol.
Exemplul 1(Hotărât la consiliu):
Exemplul 2(Puteți cere elevilor să rezolve):
| Dat: | Soluţie: |
m(H 2) \u003d 20g |
Cereți elevilor să completeze tabelul.
Substanţă |
Numărul de molecule |
Masa de materie |
Numărul de alunițe |
Masă molară |
Volum |
Material teoretic, vezi pagina „Volum molar de gaz”.
Formule și concepte de bază:
Din legea lui Avogadro, de exemplu, rezultă că, în aceleași condiții, 1 litru de hidrogen și 1 litru de oxigen conțin același număr de molecule, deși dimensiunile lor variază foarte mult.
Primul corolar al legii lui Avogadro:
Volumul care ocupă 1 mol de orice gaz în condiții normale (n.s.) este de 22,4 litri și se numește volumul molar de gaz(Vm).
V m \u003d V / ν (m 3 / mol)
Ceea ce se numește condiții normale (n.o.):
- temperatura normala = 0°C sau 273 K;
- presiune normală = 1 atm sau 760 mmHg sau 101,3 kPa
Din prima consecință a legii lui Avogadro rezultă că, de exemplu, 1 mol de hidrogen (2 g) și 1 mol de oxigen (32 g) ocupă același volum, egal cu 22,4 litri la n.o.
Cunoscând V m, puteți găsi volumul oricărei cantități (ν) și orice masă (m) de gaz:
V=V m ν V=V m (m/M)
Sarcina tipică 1: Care este volumul la n.a.s. ocupă 10 moli de gaz?
V=V m ν=22,4 10=224 (l/mol)
Sarcina tipică 2: Care este volumul la n.a.s. ia 16 g de oxigen?
V(O2)=Vm·(m/M)Mr(02)=32; M(O 2) \u003d 32 g / mol V (O 2) \u003d 22,4 (16/32) \u003d 11,2 l
Al doilea corolar al legii lui Avogadro:
Cunoscând densitatea gazului (ρ=m/V) la n.o., putem calcula masa molară a acestui gaz: M=22,4 ρ
Densitatea (D) a unui gaz se numește altfel raportul dintre masa unui anumit volum al primului gaz și masa unui volum similar al celui de-al doilea gaz, luată în aceleași condiții.
Exemplu de problemă 3: Determinați densitatea relativă a dioxidului de carbon din hidrogen și aer.
D hidrogen (CO 2) \u003d M r (CO 2) / M r (H 2) \u003d 44/2 \u003d 22 D aer \u003d 44/29 \u003d 1,5
- un volum de hidrogen și un volum de clor dau două volume de acid clorhidric: H 2 + Cl 2 \u003d 2HCl
- două volume de hidrogen și un volum de oxigen dau două volume de vapori de apă: 2H 2 + O 2 \u003d 2H 2 O
Sarcina 1 . Câte moli și molecule sunt conținute în 44 g de dioxid de carbon.
Soluţie:
M(CO 2) \u003d 12 + 16 2 \u003d 44 g / mol ν \u003d m / M \u003d 44/44 \u003d 1 mol N (CO 2) \u003d ν N A \u003d 1 6.02 6.02 100 3 \u003d 10 23
Sarcina 2. Calculați masa unei molecule de ozon și a unui atom de argon.
Soluţie:
M(O 3) \u003d 16 3 \u003d 48 g m (O 3) \u003d M (O 3) / N A \u003d 48 / (6,02 10 23) \u003d 7,97 10 -23 g M (Ar) \u00 g md (Ar) \u003d M (Ar) / N A \u003d 40 / (6,02 10 23) \u003d 6,65 10 -23 g
Sarcina 3. Care este volumul la n.o. ocupă 2 moli de metan.
Soluţie:
ν \u003d V / 22,4 V (CH 4) \u003d ν 22,4 \u003d 2 22,4 \u003d 44,8 l
Sarcina 4. Determinați densitatea și densitatea relativă a monoxidului de carbon (IV) pentru hidrogen, metan și aer.
Soluţie:
Mr (C02)=12+16.2=44; M(C02)=44 g/mol Mr (CH4)=12+14=16; M(CH4)=16 g/mol Mr(H2)=12=2; M(H2)=2 g/mol Mr (aer)=29; M (aer) \u003d 29 g / mol ρ \u003d m / V ρ (CO 2) \u003d 44 / 22,4 \u003d 1,96 g / mol D (CH 4) \u003d M (CO 2) / M (CH 4) = 44/16=2,75 D(H2)=M(C02)/M(H2)=44/2=22 D(aer)=M(CO2)/M(aer)=44/24= 1,52
Sarcina 5. Determinați masa amestecului de gaze, care include 2,8 metri cubi de metan și 1,12 metri cubi de monoxid de carbon.
Soluţie:
Mr (C02)=12+16.2=44; M(C02)=44 g/mol Mr (CH4)=12+14=16; M(CH 4) \u003d 16 g / mol 22,4 metri cubi CH 4 \u003d 16 kg 2,8 metri cubi CH 4 \u003d x m (CH 4) \u003d x \u003d 2,8 16 / 22,4 \u003d 2 kg metri cubi CO2 \u003d 28 kg 1,12 metri cubi CO 2 \u003d x m (CO 2) \u003d x \u003d 1,12 28 / 22,4 \u003d 1,4 kg m (CH 4) + m (CO 2) \u003d 2 + 1,4 kg
Sarcina 6. Determinați volumele de oxigen și aer necesare arderii a 112 metri cubi de monoxid de carbon divalent cu conținutul de impurități incombustibile în fracțiuni de volum de 0,50.
Soluţie:
- determinați volumul de CO pur din amestec: V (CO) \u003d 112 0,5 \u003d 66 metri cubi
- determinați volumul de oxigen necesar pentru arderea a 66 de metri cubi de CO: 2CO + O 2 \u003d 2CO 2 2mol + 1mol 66m 3 + X m 3 V (CO) \u003d 2 22,4 \u003d 44,8 m 3 V (O 2) \ u003d 22,4 m 3 66 / 44,8 \u003d X / 22,4 X \u003d 66 22,4 / 44,8 \u003d 33 m 3 sau 2V (CO) / V (O 2) \u003d V 0 (CO) / V 0 (CO) / V ) V - volumele molare V 0 - volumele calculate V 0 (O 2) \u003d V (O 2) (V 0 (CO) / 2V (CO))
Sarcina 7. Cum se va schimba presiunea într-un vas plin cu hidrogen și clor gazos după ce acestea reacţionează? La fel și pentru hidrogen și oxigen?
Soluţie:
- H 2 + Cl 2 \u003d 2HCl - ca urmare a interacțiunii a 1 mol de hidrogen și 1 mol de clor, se obțin 2 moli de acid clorhidric: 1 (mol) + 1 (mol) \u003d 2 (mol), prin urmare, presiunea nu se va modifica, deoarece volumul rezultat al amestecului de gaze este suma volumelor componentelor implicate în reacție.
- 2H 2 + O 2 \u003d 2H 2 O - 2 (mol) + 1 (mol) \u003d 2 (mol) - presiunea din vas va scădea de o dată și jumătate, deoarece s-au obținut 2 volume de amestec de gaze din 3 volume de componente care au intrat în reacţie.
Sarcina 8. 12 litri dintr-un amestec gazos de amoniac și monoxid de carbon tetravalent la n.s.a. au masa de 18 g. Cât este în amestecul fiecăruia dintre gaze?
Soluţie:
V(NH 3)=x l V(CO 2)=y l M(NH 3)=14+1 3=17 g/mol M(CO 2)=12+16 2=44 g/mol m( NH 3) \ u003d x / (22.4 17) g m (CO 2) \u003d y / (22.4 44) g Sistemul de ecuații volumul amestecului: x + y \u003d 12 masa amestecului: x / (22.4 ) 17)+y/(22.4 44) =18 După rezolvare obținem: x=4,62 l y=7,38 l
Sarcina 9. Câtă apă se va obține în urma reacției a 2 g de hidrogen și 24 g de oxigen.
Soluţie:
2H 2 + O 2 \u003d 2H 2 O
Din ecuația reacției se poate observa că numărul de reactanți nu corespunde raportului dintre coeficienții stoichiometrici din ecuație. În astfel de cazuri, calculele sunt efectuate pe substanță, care este mai mică, adică această substanță se va termina prima în cursul reacției. Pentru a determina care dintre componente este insuficientă, trebuie să acordați atenție coeficientului din ecuația de reacție.
Cantități de componente inițiale ν(H2)=4/2=2 (mol) ν(O2)=48/32=1,5 (mol)
Cu toate acestea, nu este nevoie să vă grăbiți. În cazul nostru, pentru reacția cu 1,5 moli de oxigen sunt necesari 3 moli de hidrogen (1,5 2) și avem doar 2 moli din acesta, adică 1 mol de hidrogen nu este suficient pentru toți un moli și jumătate de oxigenul să reacționeze. Prin urmare, vom calcula cantitatea de apă prin hidrogen:
ν (H 2 O) \u003d ν (H 2) \u003d 2 mol m (H 2 O) \u003d 2 18 \u003d 36 g
Sarcina 10. La o temperatură de 400 K și o presiune de 3 atmosfere, gazul ocupă un volum de 1 litru. Ce volum va ocupa acest gaz la n.a.s.?
Soluţie:
Din ecuația Clapeyron:
P V/T = P n V n /T n V n = (PVT n)/(P n T) V n = (3 1 273)/(1 400) = 2,05 l
Denumiri de acizi sunt formate din denumirea rusă a atomului de acid central cu adăugarea de sufixe și terminații. Dacă starea de oxidare a atomului central al acidului corespunde numărului de grup al sistemului periodic, atunci denumirea se formează folosind cel mai simplu adjectiv din denumirea elementului: H 2 SO 4 - acid sulfuric, HMnO 4 - acid mangan . Dacă elementele formatoare de acid au două stări de oxidare, atunci starea intermediară de oxidare este indicată prin sufixul -ist-: H 2 SO 3 - acid sulfuros, HNO 2 - acid azot. Pentru denumirile acizilor halogen cu multe stări de oxidare se folosesc diverse sufixe: exemple tipice - HClO 4 - clor n acidul, HClO 3 - clor novat acidul, HClO 2 - clor ist acid, HClO - clor novatist acid (acidul anoxic HCl se numește acid clorhidric – de obicei acid clorhidric). Acizii pot diferi în ceea ce privește numărul de molecule de apă care hidratează oxidul. Acizii care conțin cel mai mare număr de atomi de hidrogen se numesc ortoacizi: H 4 SiO 4 - acid ortosilicic, H 3 PO 4 - acid fosforic. Acizii care conțin 1 sau 2 atomi de hidrogen se numesc metaacizi: H 2 SiO 3 - acid metasilicic, HPO 3 - acid metafosforic. Se numesc acizi care conțin doi atomi centrali di acizi: H 2 S 2 O 7 - acid disulfuric, H 4 P 2 O 7 - acid difosforic.
Numele compușilor complecși sunt formate în același mod ca nume de sare, dar cationului sau anionului complex i se dă o denumire sistematică, adică se citește de la dreapta la stânga: K 3 - hexafluoroferat de potasiu (III), SO 4 - sulfat de cupru (II) tetraamină.
Denumiri de oxizi sunt formate folosind cuvântul „oxid” și cazul genitiv al numelui rusesc al atomului central de oxid, indicând, dacă este necesar, gradul de oxidare al elementului: Al 2 O 3 - oxid de aluminiu, Fe 2 O 3 - oxid de fier (III).
Nume de bază se formează folosind cuvântul „hidroxid” și cazul genitiv al numelui rusesc al atomului central de hidroxid, indicând, dacă este necesar, gradul de oxidare al elementului: Al (OH) 3 - hidroxid de aluminiu, Fe (OH) 3 - hidroxid de fier (III).
Numele compușilor cu hidrogen se formează în funcţie de proprietăţile acido-bazice ale acestor compuşi. Pentru compușii gazoși formatori de acid cu hidrogen se folosesc denumirile: H 2 S - sulfan (hidrogen sulfurat), H 2 Se - selan (hidrogen selenidură), HI - hidrogen iod; soluțiile lor în apă se numesc, respectiv, acizi hidrosulfuri, hidroselenic și iodhidric. Pentru unii compuși cu hidrogen se folosesc denumiri speciale: NH 3 - amoniac, N 2 H 4 - hidrazină, PH 3 - fosfină. Compușii cu hidrogen având o stare de oxidare de –1 se numesc hidruri: NaH este hidrură de sodiu, CaH 2 este hidrură de calciu.
Denumiri de săruri sunt formate din denumirea latină a atomului central al reziduului acid cu adăugarea de prefixe și sufixe. Numele sărurilor binare (cu două elemente) sunt formate folosind sufixul - id: NaCl - clorură de sodiu, Na 2 S - sulfură de sodiu. Dacă atomul central al unui reziduu de acid care conține oxigen are două stări de oxidare pozitive, atunci cea mai mare stare de oxidare este indicată de sufixul - la: Na2S04-sulf la sodiu, KNO 3 - nitr la potasiu și cea mai scăzută stare de oxidare - sufixul - aceasta: Na2S03-sulf aceasta sodiu, KNO 2 - nitr aceasta potasiu. Pentru denumirea sărurilor de halogeni care conțin oxigen, se folosesc prefixe și sufixe: KClO 4 - BANDĂ clor la potasiu, Mg (ClO 3) 2 - clor la magneziu, KClO 2 - clor aceasta potasiu, KClO - hipo clor aceasta potasiu.
Saturație covalentăsconexiunea ei- se manifestă prin faptul că nu există electroni neperechi în compușii elementelor s- și p, adică toți electronii neperechi ai atomilor formează perechi de electroni de legătură (excepțiile sunt NO, NO 2, ClO 2 și ClO 3).
Perechile de electroni singuri (LEP) sunt electroni care ocupă orbitalii atomici în perechi. Prezența NEP determină capacitatea anionilor sau moleculelor de a forma legături donor-acceptor ca donatori de perechi de electroni.
Electroni nepereche - electroni ai unui atom, conținuți unul câte unul în orbital. Pentru elementele s și p, numărul de electroni nepereche determină câte perechi de electroni de legătură poate forma un anumit atom cu alți atomi prin mecanismul de schimb. Metoda legăturii de valență presupune că numărul de electroni nepereche poate fi crescut de perechi de electroni neîmpărțiți dacă există orbiti liberi în nivelul electronic de valență. În majoritatea compușilor elementelor s și p, nu există electroni neperechi, deoarece toți electronii neperechi ai atomilor formează legături. Cu toate acestea, moleculele cu electroni nepereche există, de exemplu, NO, NO 2 , ele sunt foarte reactive și tind să formeze dimeri de tip N 2 O 4 datorită electronilor neperechi.
Concentrație normală - este numărul de moli echivalente in 1 litru de solutie.
Conditii normale - temperatura 273K (0 o C), presiune 101,3 kPa (1 atm).
Mecanisme de schimb și donor-acceptor de formare a legăturilor chimice. Formarea legăturilor covalente între atomi poate avea loc în două moduri. Dacă formarea unei perechi de electroni de legătură are loc datorită electronilor neperechi ai ambilor atomi legați, atunci această metodă de formare a unei perechi de electroni de legătură se numește mecanism de schimb - atomii fac schimb de electroni, în plus, electronii de legătură aparțin ambilor atomi legați. . Dacă perechea de electroni de legătură este formată din cauza perechii de electroni singure a unui atom și a orbitalului vacant al altui atom, atunci o astfel de formare a perechii de electroni de legătură este un mecanism donor-acceptor (vezi Fig. metoda legăturii de valență).
Reacții ionice reversibile - acestea sunt reacții în care se formează produse care sunt capabile să formeze substanțe inițiale (dacă ținem cont de ecuația scrisă, atunci despre reacțiile reversibile putem spune că pot proceda în ambele sensuri cu formarea de electroliți slabi sau de compuși slab solubili) . Reacțiile ionice reversibile sunt adesea caracterizate prin conversie incompletă; întrucât în timpul unei reacții ionice reversibile se formează molecule sau ioni care provoacă o deplasare către produșii de reacție inițiali, adică „încetinesc” reacția, parcă. Reacțiile ionice reversibile sunt descrise folosind semnul ⇄, iar reacțiile ireversibile sunt descrise folosind semnul →. Un exemplu de reacție ionică reversibilă este reacția H 2 S + Fe 2+ ⇄ FeS + 2H +, iar un exemplu de reacție ireversibilă este S 2- + Fe 2+ → FeS.
Oxidanți – substanţe în care în timpul reacţiilor redox scad stările de oxidare ale unor elemente.
Dualitate redox - capacitatea de a acționa a substanțelor reacții redox ca agent oxidant sau agent reducător, în funcţie de partener (de exemplu, H2O2, NaN02).
Reacții redox(OVR) - Acestea sunt reacții chimice în timpul cărora stările de oxidare ale elementelor reactanților se modifică.
Potential redox - o valoare care caracterizează capacitatea redox (rezistența) atât a agentului oxidant, cât și a agentului reducător, care alcătuiesc semireacția corespunzătoare. Astfel, potențialul redox al perechii Cl 2 /Cl -, egal cu 1,36 V, caracterizează clorul molecular ca agent de oxidare și ionul de clorură ca agent reducător.
oxizi - compuși ai elementelor cu oxigen, în care oxigenul are o stare de oxidare de -2.
Interacțiuni de orientare– interacțiuni intermoleculare ale moleculelor polare.
osmoza - fenomenul de transfer al moleculelor de solvent pe o membrană semipermeabilă (numai permeabilă la solvent) către o concentrație mai mică de solvent.
Presiune osmotica - Proprietatea fizico-chimică a soluțiilor, datorită capacității membranelor de a trece numai molecule de solvent. Presiunea osmotică din partea soluției mai puțin concentrate egalizează ratele de penetrare a moleculelor de solvent pe ambele părți ale membranei. Presiunea osmotică a unei soluții este egală cu presiunea unui gaz în care concentrația de molecule este aceeași cu concentrația de particule din soluție.
Fundamente după Arrhenius - substanțe care, în procesul de disociere electrolitică, desprind ionii de hidroxid.
Fundații conform lui Bronsted - compuși (molecule sau ioni precum S 2-, HS -) care pot atașa ioni de hidrogen.
Fundații conform lui Lewis (bazele lui Lewis) – compuși (molecule sau ioni) cu perechi de electroni neîmpărțiți capabili să formeze legături donor-acceptor. Cea mai comună bază Lewis sunt moleculele de apă, care au proprietăți puternice de donator.
În chimie, nu se folosesc valorile maselor absolute ale moleculelor, ci se folosește valoarea masei moleculare relative. Acesta arată de câte ori masa unei molecule este mai mare decât 1/12 din masa unui atom de carbon. Această valoare este notată cu M r .
Greutatea moleculară relativă este egală cu suma maselor atomice relative ale atomilor săi constitutivi. Calculați greutatea moleculară relativă a apei.
Știți că o moleculă de apă conține doi atomi de hidrogen și un atom de oxigen. Apoi masa sa moleculară relativă va fi egală cu suma produselor masei atomice relative a fiecărui element chimic și numărul atomilor săi dintr-o moleculă de apă:
Cunoscând greutățile moleculare relative ale substanțelor gazoase, se pot compara densitățile acestora, adică se calculează densitatea relativă a unui gaz din altul - D (A / B). Densitatea relativă a gazului A pentru gazul B este egală cu raportul dintre masele lor moleculare relative:

Calculați densitatea relativă a dioxidului de carbon pentru hidrogen:
Acum calculăm densitatea relativă a dioxidului de carbon pentru hidrogen:
D(co.g./hidrogen.) = Mr (co.g.): Mr (hidrogen.) = 44:2 = 22.
Astfel, dioxidul de carbon este de 22 de ori mai greu decât hidrogenul.
După cum știți, legea lui Avogadro se aplică numai substanțelor gazoase. Dar chimiștii trebuie să aibă o idee despre numărul de molecule și în porțiuni de substanțe lichide sau solide. Prin urmare, pentru a compara numărul de molecule din substanțe, chimiștii au introdus valoarea - Masă molară .
Se notează masa molară M, este numeric egal cu greutatea moleculară relativă.
Raportul dintre masa unei substanțe și masa sa molară se numește cantitate de substanță .
Se notează cantitatea de substanță n. Aceasta este o caracteristică cantitativă a unei porțiuni dintr-o substanță, împreună cu masa și volumul. Cantitatea de substanță se măsoară în moli.

Cuvântul „aluniță” provine de la cuvântul „moleculă”. Numărul de molecule în cantități egale dintr-o substanță este același.
S-a stabilit experimental că 1 mol dintr-o substanță conține particule (de exemplu, molecule). Acest număr se numește numărul lui Avogadro. Și dacă îi adăugați o unitate de măsură - 1 / mol, atunci va fi o mărime fizică - constanta Avogadro, care se notează N A.
Masa molară se măsoară în g/mol. Semnificația fizică a masei molare este că această masă este 1 mol dintr-o substanță.
Conform legii lui Avogadro, 1 mol de orice gaz va ocupa același volum. Volumul unui mol de gaz se numește volum molar și se notează cu V n .
În condiții normale (și aceasta este 0 ° C și presiune normală - 1 atm. Sau 760 mm Hg sau 101,3 kPa), volumul molar este de 22,4 l / mol.
Apoi cantitatea de substanță gazoasă la n.o. poate fi calculat ca raportul dintre volumul gazului și volumul molar.

SARCINA 1. Ce cantitate de substanță corespunde cu 180 g de apă?

SARCINA 2. Să calculăm volumul la n.o., care va fi ocupat de dioxid de carbon în cantitate de 6 mol.

Bibliografie
- Culegere de sarcini și exerciții la chimie: clasa a VIII-a: la manualul de P.A. Orzhekovsky și alții „Chimie, clasa a 8-a” / P.A. Orjekovski, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006. (p. 29-34)
- Ushakova O.V. Caiet de chimie: clasa a VIII-a: la manualul de P.A. Orjekovski și alții „Chimie. Gradul 8” / O.V. Ushakova, P.I. Bespalov, P.A. Orjekovski; sub. ed. prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (p. 27-32)
- Chimie: clasa a VIII-a: manual. pentru general instituții / P.A. Orjekovski, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005. (§§ 12, 13)
- Chimie: inorg. chimie: manual. pentru 8 celule. instituție generală / GE. Rudzitis, F.G. Feldman. - M .: Educație, SA „Manuale de la Moscova”, 2009. (§§ 10, 17)
- Enciclopedie pentru copii. Volumul 17. Chimie / Capitolul. editat de V.A. Volodin, conducând. științific ed. I. Leenson. - M.: Avanta +, 2003.
- O singură colecție de resurse educaționale digitale ().
- Versiunea electronică a revistei „Chimie și viață” ().
- Teste de chimie (online) ().
Teme pentru acasă
1.p.69 nr. 3; p.73 nr. 1, 2, 4 din manualul „Chimie: clasa a VIII-a” (P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M .: AST: Astrel, 2005).
2. №№ 65, 66, 71, 72 din Culegerea de sarcini și exerciții la chimie: clasa a VIII-a: la manualul de P.A. Orzhekovsky și alții „Chimie, clasa a 8-a” / P.A. Orjekovski, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2006.
Împreună cu masa și volumul în calculele chimice, este adesea utilizată cantitatea unei substanțe, care este proporțională cu numărul de unități structurale conținute în substanță. In acest caz, in fiecare caz, trebuie indicat ce unitati structurale (molecule, atomi, ioni etc.) se refera. Unitatea de măsură a unei substanțe este molul.
Un mol este cantitatea dintr-o substanță care conține tot atâtea molecule, atomi, ioni, electroni sau alte unități structurale câte atomi există în 12 g de izotop de carbon 12C.
Numărul de unități structurale conținute în 1 mol de substanță (constanta lui Avogadro) este determinat cu mare precizie; în calculele practice, se ia egal cu 6,02 1024 mol -1.
Este ușor de demonstrat că masa unui mol de substanță (masă molară), exprimată în grame, este numeric egală cu greutatea moleculară relativă a acestei substanțe.
Astfel, greutatea moleculară relativă (sau greutatea moleculară pe scurt) a clorului liber C1r este 70,90. Prin urmare, masa molară a clorului molecular este de 70,90 g/mol. Cu toate acestea, masa molară a atomilor de clor este jumătate față de (45,45 g/mol), deoarece 1 mol de molecule de clor Cl conține 2 moli de atomi de clor.
Conform legii lui Avogadro, volume egale de orice gaz luate la aceeași temperatură și aceeași presiune conțin același număr de molecule. Cu alte cuvinte, același număr de molecule de orice gaz ocupă același volum în aceleași condiții. Cu toate acestea, 1 mol din orice gaz conține același număr de molecule. Prin urmare, în aceleași condiții, 1 mol de orice gaz ocupă același volum. Acest volum se numește volumul molar de gaz și în condiții normale (0 ° C, presiune 101, 425 kPa) este de 22,4 litri.
De exemplu, afirmația „conținutul de dioxid de carbon din aer este de 0,04% (vol.)” înseamnă că la o presiune parțială de CO 2 egală cu presiunea aerului și la aceeași temperatură, dioxidul de carbon conținut în aer va iau 0,04% din volumul total ocupat de aer.
Sarcina de control
1. Comparați numărul de molecule conținute în 1 g de NH 4 și 1 g de N 2. În ce caz și de câte ori numărul de molecule este mai mare?
2. Exprimați în grame masa unei molecule de dioxid de sulf.
4. Câte molecule sunt conținute în 5,00 ml de clor în condiții normale?
4. Ce volum în condiţii normale este ocupat de 27 10 21 molecule de gaz?
5. Exprimați în grame masa unei molecule de NO 2 -
6. Care este raportul dintre volumele ocupate de 1 mol de O 2 și 1 mol de Oz (condițiile sunt aceleași)?
7. Se iau mase egale de oxigen, hidrogen si metan in aceleasi conditii. Aflați raportul dintre volumele de gaze luate.
8. La întrebarea cât volum va lua 1 mol de apă în condiții normale, s-a primit răspunsul: 22,4 litri. Acesta este răspunsul corect?
9. Exprimă în grame masa unei molecule de HCl.
Câte molecule de dioxid de carbon sunt într-un litru de aer dacă volumul de CO 2 este de 0,04% (condiții normale)?
10. Câți moli sunt conținute în 1 m 4 de orice gaz în condiții normale?
11. Exprimați în grame masa unei molecule de H 2 O-
12. Câți moli de oxigen sunt în 1 litru de aer, dacă volumul
14. Câți moli de azot sunt într-un litru de aer dacă volumul său este de 78% (condiții normale)?
14. Se iau mase egale de oxigen, hidrogen si azot in aceleasi conditii. Aflați raportul dintre volumele de gaze luate.
15. Comparați numărul de molecule conținute în 1 g de NO 2 și 1 g de N 2. În ce caz și de câte ori numărul de molecule este mai mare?
16. Câte molecule sunt conținute în 2,00 ml de hidrogen în condiții normale?
17. Exprimați în grame masa unei molecule de H 2 O-
18. Ce volum în condiții normale este ocupat de 17 10 21 molecule de gaz?
RATEA REACȚILOR CHIMICE
La definirea conceptului viteza de reactie chimica este necesar să se facă distincția între reacțiile omogene și eterogene. Dacă reacția se desfășoară într-un sistem omogen, de exemplu, într-o soluție sau într-un amestec de gaze, atunci ea are loc în întregul volum al sistemului. Viteza unei reacții omogene numită cantitatea de substanță care intră într-o reacție sau se formează ca urmare a unei reacții pe unitatea de timp într-o unitate de volum a sistemului. Deoarece raportul dintre numărul de moli ai unei substanțe și volumul în care este distribuită este concentrația molară a substanței, viteza unei reacții omogene poate fi, de asemenea, definită ca modificarea concentrației pe unitatea de timp a oricăreia dintre substanțe: reactivul inițial sau produsul de reacție. Pentru a vă asigura că rezultatul calculului este întotdeauna pozitiv, indiferent dacă este produs de un reactiv sau de un produs, semnul „±” este utilizat în formula:
În funcție de natura reacției, timpul poate fi exprimat nu numai în secunde, așa cum este cerut de sistemul SI, ci și în minute sau ore. În timpul reacției, valoarea vitezei sale nu este constantă, ci se modifică continuu: scade, deoarece concentrațiile substanțelor inițiale scad. Calculul de mai sus dă valoarea medie a vitezei de reacție pe un anumit interval de timp Δτ = τ 2 – τ 1 . Viteza adevărată (instantanee) este definită ca limita până la care raportul Δ DIN/ Δτ la Δτ → 0, adică viteza adevărată este egală cu derivata în timp a concentrației.
Pentru o reacție a cărei ecuație conține coeficienți stoichiometrici care diferă de unitate, valorile ratei exprimate pentru diferite substanțe nu sunt aceleași. De exemplu, pentru reacția A + 4B \u003d D + 2E, consumul de substanță A este de un mol, substanța B este de trei moli, sosirea substanței E este de doi moli. De aceea υ (A) = ⅓ υ (B) = υ (D)=½ υ (E) sau υ (E). = ⅔ υ (AT).
Dacă o reacție are loc între substanțe care se află în diferite faze ale unui sistem eterogen, atunci ea poate avea loc numai la interfața dintre aceste faze. De exemplu, interacțiunea dintre o soluție acidă și o bucată de metal are loc numai pe suprafața metalului. Viteza unei reacții eterogene numită cantitatea de substanță care intră într-o reacție sau care se formează ca rezultat al unei reacții pe unitatea de timp pe unitatea de interfață dintre faze:
 .
.
Dependența vitezei unei reacții chimice de concentrația reactanților este exprimată prin legea acțiunii masei: la o temperatură constantă, viteza unei reacții chimice este direct proporțională cu produsul concentrațiilor molare ale reactanților ridicate la puteri egale cu coeficienții din formulele acestor substanțe din ecuația reacției.. Apoi pentru reacție
2A + B → produse
raportul υ ~ · DIN A 2 DIN B, iar pentru trecerea la egalitate se introduce coeficientul de proporționalitate k, numit constanta vitezei de reacție:
υ = k· DIN A 2 DIN B = k[A] 2 [V]
(concentrațiile molare în formule pot fi notate cu litera DIN cu indicele corespunzător și formula substanței cuprinsă între paranteze drepte). Sensul fizic al constantei vitezei de reacție este viteza de reacție la concentrații ale tuturor reactanților egale cu 1 mol/l. Dimensiunea constantei vitezei de reacție depinde de numărul de factori din partea dreaptă a ecuației și poate fi de la -1; s –1 (l/mol); s –1 (l 2 / mol 2), etc., adică astfel încât, în orice caz, în calcule, viteza de reacție să fie exprimată în mol l –1 s –1.
Pentru reacțiile eterogene, ecuația legii acțiunii masei include concentrațiile numai acelor substanțe care se află în fază gazoasă sau în soluție. Concentrația unei substanțe în faza solidă este o valoare constantă și este inclusă în constanta de viteză, de exemplu, pentru procesul de ardere a cărbunelui C + O 2 = CO 2, legea acțiunii masei se scrie:
υ = k eu const = k·,
Unde k= k eu const.
În sistemele în care una sau mai multe substanțe sunt gaze, viteza de reacție depinde și de presiune. De exemplu, atunci când hidrogenul interacționează cu vaporii de iod H 2 + I 2 \u003d 2HI, viteza unei reacții chimice va fi determinată de expresia:
υ = k··.
Dacă presiunea este crescută, de exemplu, de 4 ori, atunci volumul ocupat de sistem va scădea cu aceeași cantitate și, în consecință, concentrația fiecăreia dintre substanțele care reacţionează va crește cu aceeași cantitate. Viteza de reacție în acest caz va crește de 9 ori
Dependența de temperatură a vitezei de reacție este descris de regula van't Hoff: pentru fiecare creștere de 10 grade a temperaturii, viteza de reacție crește de 2-4 ori. Aceasta înseamnă că, pe măsură ce temperatura crește exponențial, viteza unei reacții chimice crește exponențial. Baza în formula de progresie este coeficientul de temperatură al vitezei de reacțieγ, care arată de câte ori crește viteza unei reacții date (sau, ceea ce este același, constanta de viteză) cu o creștere a temperaturii cu 10 grade. Matematic, regula van't Hoff este exprimată prin formulele:
 sau
sau 
unde și sunt ratele de reacție, respectiv, la inițială t 1 si finala t 2 temperaturi. Regula lui Van't Hoff mai poate fi exprimată astfel:
![]() ;
;  ;
; ![]() ;
;  ,
,
unde și sunt, respectiv, viteza și constanta de viteză a reacției la o temperatură t; și sunt aceleași valori la temperatură t +10n; n este numărul de intervale de „zece grade” ( n =(t 2 –t 1)/10) prin care temperatura s-a modificat (poate fi un număr întreg sau fracționar, pozitiv sau negativ).
Sarcina de control
1. Aflați valoarea constantei vitezei de reacție A + B -> AB, dacă la concentrații de substanțe A și B egale cu 0,05 și respectiv 0,01 mol / l, viteza de reacție este de 5 10 -5 mol / (l-min). ).
2. De câte ori se va schimba viteza de reacție 2A + B -> A2B dacă concentrația substanței A crește de 2 ori, iar concentrația substanței B se reduce de 2 ori?
4. De câte ori trebuie crescută concentrația unei substanțe, B 2 în sistemul 2A 2 (g.) + B 2 (g.) \u003d 2A 2 B (g.), astfel încât atunci când concentrația substanței A scade de 4 ori, viteza reacției directe nu se modifică?
4. La ceva timp după începerea reacției 3A + B-> 2C + D, concentrațiile de substanțe au fost: [A] = 0,04 mol/l; [B] = 0,01 mol/l; [C] \u003d 0,008 mol / l. Care sunt concentrațiile inițiale ale substanțelor A și B?
5. În sistemul CO + C1 2 = COC1 2, concentrația a fost crescută de la 0,04 la 0,12 mol / l, iar concentrația de clor - de la 0,02 la 0,06 mol / l. Cu cât a crescut rata reacției directe?
6. Reacția dintre substanțele A și B este exprimată prin ecuația: A + 2B → C. Concentrațiile inițiale sunt: [A] 0 \u003d 0,04 mol / l, [B] o \u003d 0,05 mol / l. Constanta vitezei de reacție este 0,4. Aflați viteza de reacție inițială și viteza de reacție după un timp, când concentrația substanței A scade cu 0,01 mol/l.
7. Cum se va schimba viteza reacției 2СО + О2 = 2СО2, care se desfășoară într-un vas închis, dacă presiunea se dublează?
8. Calculați de câte ori va crește viteza de reacție dacă temperatura sistemului crește de la 20 °C la 100 °C, presupunând că coeficientul de temperatură al vitezei de reacție este 4.
9. Cum se va schimba viteza de reacție 2NO(r.) + 0 2 (g.) → 2N02 (r.) dacă presiunea din sistem crește de 4 ori;
10. Cum se va schimba viteza de reacție 2NO(r.) + 0 2 (g.) → 2N02 (r.) dacă volumul sistemului este redus de 4 ori?
11. Cum se va schimba viteza de reacție 2NO(r.) + 0 2 (g.) → 2N02 (r.) dacă concentrația de NO crește de 4 ori?
12. Care este coeficientul de temperatură al vitezei de reacție dacă, cu o creștere a temperaturii cu 40 de grade, viteza de reacție
crește de 15,6 ori?
paisprezece.. Aflați valoarea constantei vitezei de reacție A + B -> AB, dacă la concentrații de substanțe A și B egale cu 0,07 și, respectiv, 0,09 mol / l, viteza de reacție este de 2,7 10 -5 mol / (l-min).
14. Reacția dintre substanțele A și B este exprimată prin ecuația: A + 2B → C. Concentrațiile inițiale sunt: [A] 0 \u003d 0,01 mol / l, [B] o \u003d 0,04 mol / l. Constanta vitezei de reacție este 0,5. Aflați viteza de reacție inițială și viteza de reacție după un timp, când concentrația substanței A scade cu 0,01 mol/l.
15. Cum se va schimba viteza de reacție 2NO(r.) + 0 2 (g.) → 2N02 (r.) dacă presiunea din sistem se dublează;
16. În sistemul CO + C1 2 = COC1 2, concentrația a fost crescută de la 0,05 la 0,1 mol / l, iar concentrația de clor - de la 0,04 la 0,06 mol / l. Cu cât a crescut rata reacției directe?
17. Calculați de câte ori va crește viteza de reacție dacă temperatura sistemului crește de la 20 °C la 80 °C, presupunând că valoarea coeficientului de temperatură al vitezei de reacție este 2.
18. Calculați de câte ori va crește viteza de reacție dacă temperatura sistemului este crescută de la 40 ° C la 90 ° C, presupunând că valoarea coeficientului de temperatură al vitezei de reacție este 4.
LEGĂTURĂ CHIMICĂ. FORMAREA SI STRUCTURA MOLECULELOR
1. Ce tipuri de legături chimice cunoașteți? Dați un exemplu de formare a unei legături ionice prin metoda legăturilor de valență.
2. Ce legătură chimică se numește covalentă? Care este caracteristica unei legături de tip covalent?
4. Ce proprietăți sunt caracterizate de o legătură covalentă? Arată acest lucru cu exemple specifice.
4. Ce tip de legătură chimică în moleculele de H 2; CI2HCI?
5. Care este natura legăturilor din molecule NCI 4, CS2, CO2? Indicați pentru fiecare dintre ele direcția de deplasare a perechii de electroni comuni.
6. Ce legătură chimică se numește ionică? Care este caracteristica unei legături ionice?
7. Ce tip de legătură există în moleculele de NaCl, N 2, Cl 2?
8. Desenați toate modalitățile posibile de suprapunere a orbitalului s cu orbitalul p;. Specificați direcția conexiunii în acest caz.
9. Explicați mecanismul donor-acceptor al unei legături covalente folosind exemplul formării ionului fosfoniu [РН 4 ]+.
10. În moleculele de CO, CO 2, legătura este polară sau nepolară? Explica. Descrie o legătură de hidrogen.
11. De ce unele molecule care au legături polare sunt în general nepolare?
12. Tipul covalent sau ionic de legătură este tipic pentru următorii compuși: Nal, S0 2 , KF? De ce este o legătură ionică cazul limită al unei legături covalente?
14. Ce este o legătură metalică? Cum este diferită de o legătură covalentă? Ce proprietăți ale metalelor provoacă?
14. Care este natura legăturilor dintre atomi din molecule; KHF2, H20, HNO ?
15. Cum se explică rezistența mare a legăturii dintre atomi din molecula de azot N 2 și rezistența mult mai mică a moleculei de fosfor P 4?
16 . Ce este o legătură de hidrogen? De ce formarea legăturilor de hidrogen nu este tipică pentru moleculele H2S și HC1, spre deosebire de H2O și HF?
17. Ce legătură se numește ionică? Are o legătură ionică proprietăți de saturație și direcționalitate? De ce este cazul limitativ al unei legături covalente?
18. Ce tip de legătură există în moleculele de NaCl, N 2, Cl 2?